Jest to druga część artykułu, którego I część została opublikowana w lutowym wydaniu „Rolniczego ABC” — nr 2 (329) luty 2018 r.
Jakość białka kiszonek determinuje wydajność i emisję azotu do środowiska. Do czynników wpływających na degradację żwaczową zalicza się: gatunek rośliny (białko lucerny jest bardziej podatne na rozkład niż inne gatunki), faza wegetacji, stopień podsuszenia, dodatki do zakiszania (dodatek kwasu mrówkowego w połączeniu z 24 godzinnym podsuszaniem znacznie ogranicza rozkład związków azotowych w kiszonkach z traw).
Poprawa bilansu azotu u przeżuwaczy
Produkty rozkładu zawiązków azotowych w żwaczu są następnie wykorzystywane przez mikroorganizmy do syntezy własnego białka, będącego głównym źródłem białka dostępnego dla przeżuwaczy. W związku z występowaniem proteolizy a wraz z nią wzrostem zawartości zawiązków azotowych niebiałkowych w azocie ogólnym, trudna jest synchronizacja dostarczania azotu kiszonki (w skutek degradacji białka) i substratów energetycznych (ze składników ścian komórek roślinnych) dla mikroorganizmów żwacza. W związku z tym, azot kiszonki wykorzystywany jest mało efektywnie do syntezy białka mikrobiologicznego. Przy deficycie energii, efektywność tej syntezy jest szczególnie ograniczona. W takiej sytuacji straty azotu w moczu wzrastają, wpływając na zanieczyszczenie środowiska i wzrost kosztów żywienia. Powszechnie stosowaną metodą poprawy bilansu azotu u przeżuwaczy jest wzrost udziału pasz wysokoskrobiowych w dawce. Jednak ze względu na ryzyko kwasicy, wymagana jest szczególna ostrożność w ich stosowaniu. Można także zwiększyć udział białka o niskiej rozkładalności w żwaczu w postaci śrut poekstrakcyjnych, co zwiększy syntezę białka, ale pogorszy skuteczność wykorzystania azotu ogółem. Poprawę efektywności wykorzystania azotu można osiągnąć przede wszystkim przez ograniczenie proteolizy w trakcie kiszenia.
Zawartość związków azotowych w zielonkach
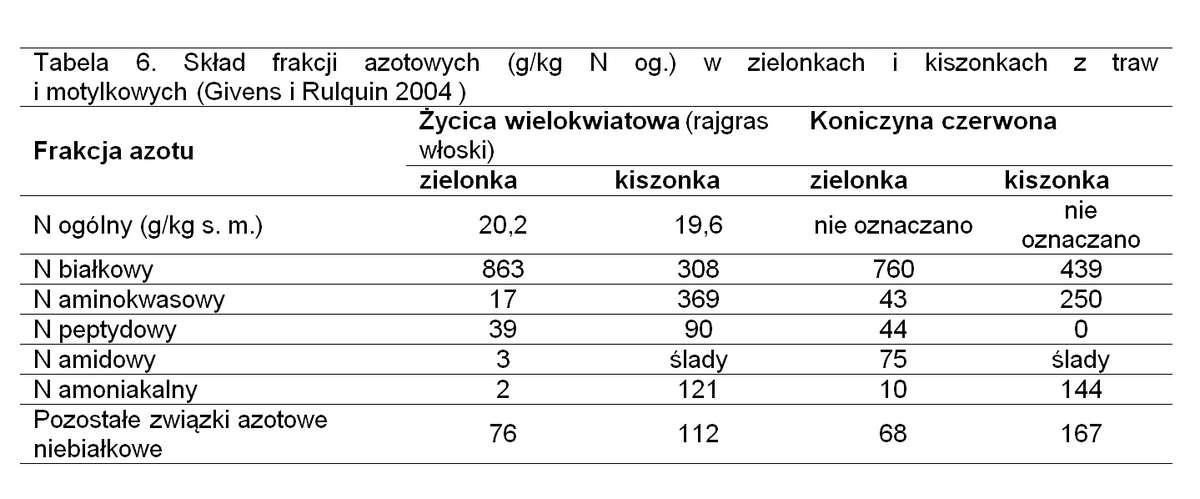
Związki azotowe (białko ogólne) występują w zielonkach i uzyskanych z nich kiszonkach w postaci białka właściwego oraz związków azotowych niebiałkowych (NPN), w różnych proporcjach. W zielonkach z traw około 75-90 proc. azotu ogólnego występuje jako białko właściwe. Nie jest ono pełnowartościowe, a aminokwasem ograniczającym jego wartość biologiczną jest najczęściej metionina i histydyna. Skład aminokwasowy białka zielonek z traw nie zmienia się znacznie w zależności od gatunku rośliny. Głównym czynnikiem wpływającym zarówno na zawartość białka jak i aminokwasów w zielonkach jest faza wegetacji.
Poziom białka może obniżyć się wraz z dojrzewaniem roślin nawet o około 85 proc. przede wszystkim na rzecz węglowodanów strukturalnych. Nawożenie azotowe również ma znaczący wpływ na zawartość białka w roślinach.
Związki azotowe niebiałkowe (NPN) stanowią 10-25 proc. białka (azotu) ogólnego w zielonkach. Wśród nich znajdują się wolne aminokwasy, peptydy, aminy, amidy, mocznik, zasady purynowe i pirymidynowe, azotany i azotyny. Skład wolnych aminokwasów występujących w zielonkach jest bardzo zróżnicowany i zależy od gatunku rośliny, fazy wegetacji i warunków środowiskowych.
Przemiany związków azotowych podczas kiszenia
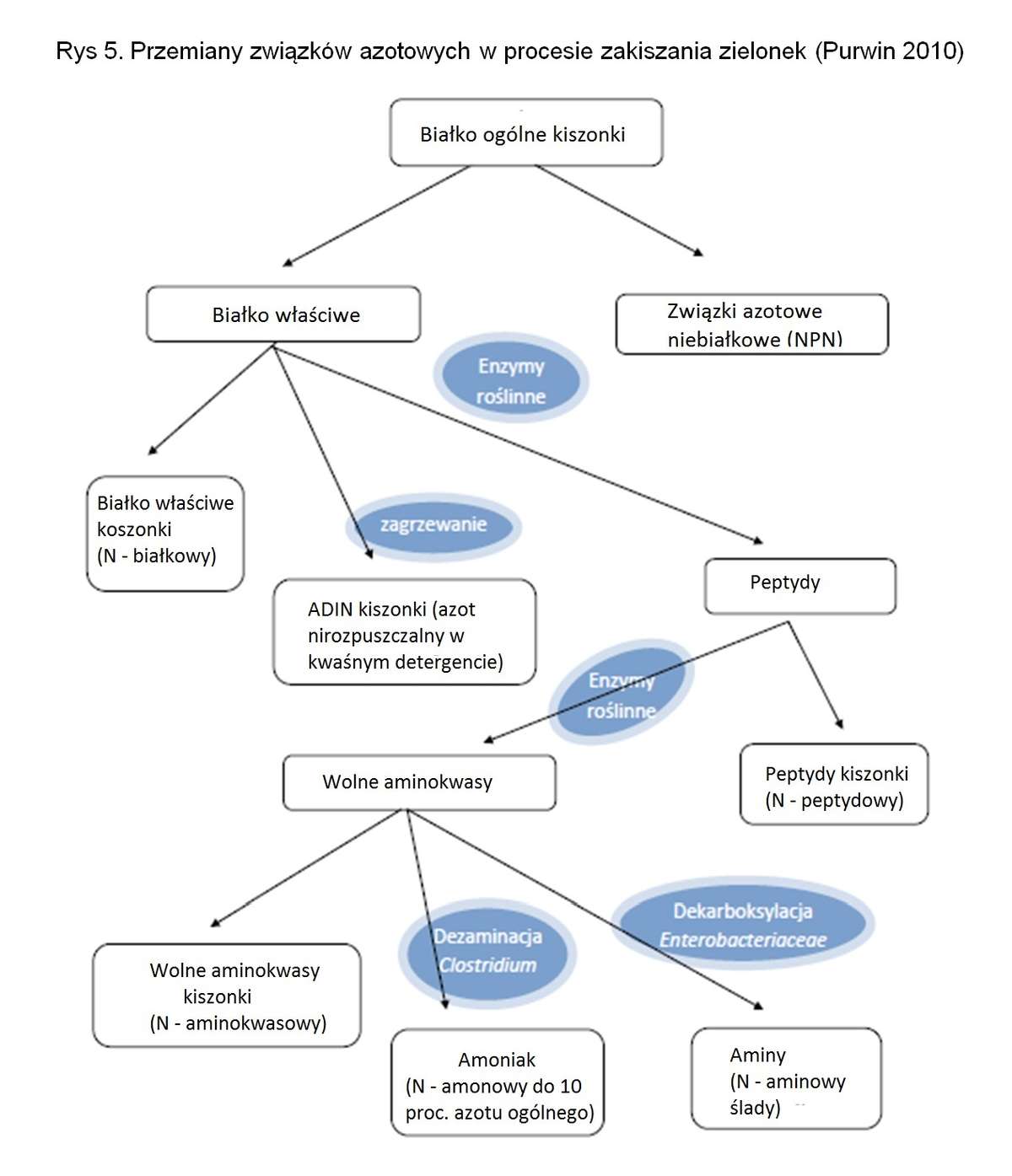
Przemiany związków azotowych zachodzą na każdym etapie technologicznym podczas produkcji kiszonek. Rozpoczynają się już po ścięciu roślin, intensywnie przebiegają w trakcie zakiszania, przechowywania kiszonki. W następstwie ścięcia roślin w czasie zbioru zielonki zachodzi w komórkach roślinnych proces hydrolizy białka (proteolizy). Wynika on nie tylko z działalności mikroflory epifitycznej, lecz przede wszystkim enzymów (proteaz) obecnych w komórkach roślinnych. Potwierdzają to doświadczenia na roślinach wolnych od bakterii, w których odnotowano nawet 70 proc. obniżenie zawartości białka właściwego. Mikroorganizmy natomiast odpowiadają za przemiany związków będących produktami proteolizy. Wśród czynników determinujących zakres hydrolizy białka podczas zakiszania wyróżnia się: zawartość suchej masy, pH, temperatura, obecność inhibitorów oraz gatunek rośliny, z których dwa pierwsze odgrywają największą rolę.
Zwiększenie zawartości suchej masy często ogranicza proces proteolizy. Jednak podsuszanie nie zawsze poprawia jakość białka, czego przyczyną może być wolniejsze obniżanie pH i hamowanie zakwaszenia. Wiadomo natomiast, że przedłużanie okresu podsuszania roślin szczególnie w wilgotnych warunkach pogodowych powoduje zwiększenie intensywności proteolizy.
Już w ciągu pierwszych 24 godzin zakiszania materiału świeżego lub przewiędniętego, zawartość białka w całkowitej puli azotu może obniżyć się z 80 do 60 proc. Głównym produktem hydrolizy białka podczas podsuszania są peptydy, wolne aminokwasy i amidy. W badaniach nad zawartością frakcji azotowych w podsuszanej przez 26,5 godziny życicy wielokwiatowej stwierdzono największy wzrost udziału azotu aminokwasowego, z relatywnie niskim wzrostem azotu amoniakalnego i amidowego. Jak z tego wynika im wolniejsze obniżanie pH, tym więcej białka właściwego zostaje rozłożonego podczas zakiszania zielonki.
Między poszczególnymi gatunkami roślin istnieją różnice w podatności na rozkład białka wynikające z aktywności proteaz. Optymalne pH dla aktywności proteaz roślinnych według różnych badań wynosi dla lucerny 5,5-6,5, koniczyny czerwonej 5,5-7, traw 6 i zależy od temperatury. Proteazy mają dużą tolerancję na wysokie temperatury i najwyższą aktywność wykazują w temperaturze 45-55 stopni Celsjusza. Dlatego jej wzrost w silosie prowadzi do wzrostu ich aktywności.
Stopień zagrzewania się zakiszanej masy uzależniony jest od dostępu tlenu, w związku z czym ważne jest, żeby zakiszany surowiec był dobrze ugnieciony a silos szybko napełniony i dokładnie zabezpieczony przed dostępem powietrza. Proces zagrzewania jest szczególnie niebezpieczny dla jakości białka, ponieważ wysoka temperatura powoduje powstawanie trwałych kompleksów białka i węglowodanów strukturalnych nie trawionych przez enzymy bakteryjne w żwaczu oraz enzymy jelitowe. Związki te tworzą frakcję azotu nierozpuszczalnego w kwaśnym detergencie (ADIN), który jest wydalany w kale.
Ponadto związki wchodzące w skład frakcji ADIN obniżają smakowitość kiszonek. Zwiększenie udziału ADIN może wystąpić w kiszonkach produkowanych w belach cylindrycznych przy zbyt niskim stopniu ugniecenia oraz wydłużonym okresem od uformowania beli do jej owinięcia folią.
Końcowymi produktami proteolizy zachodzącej podczas zakiszania są wolne aminokwasy, amoniak i inne związki azotowe niebiałkowe (NPN). Proporcje między nimi zależą od stopnia rozkładu aminokwasów. Rozkład ten zachodzi w procesie fermentacji, w którym Clostridium z grupy proteolitycznej oraz Enterobacteriaceae selektywnie rozkładają aminokwasy na drodze dezaminacji, dekarboksylacji i reakcji Sticklanda. Ilość amoniaku obecnego w kiszonce jest wskaźnikiem zakresu aktywności proteolitycznej Clostridium.
Wśród mikroorganizmów także Enterobacteriaceae produkuje pewną pulę amoniaku ze względu na zdolność przeprowadzania deaminacji, ale głównie prowadzą one dekarboksylację aminokwasów. Tak więc charakter fermentacji zachodzącej w danej kiszonce może znacząco wpłynąć na udział poszczególnych frakcji azotowych, a także poprzez stopień rozkładu poszczególnych aminokwasów na zmiany w składzie frakcji wolnych aminokwasów. Udział azotu amonowego w azocie ogólnym przekraczający 10 proc. świadczy o dużym natężeniu negatywnych zmian w składzie frakcji wolnych aminokwasów oraz powstaniu także znacznej ilości innych produktów rozkładu białka takich jak aminy biogenne (histamina, putrescyna, kadaweryna, tyramina). Zarówno amoniak jak i aminy należą do głównych czynników obniżających smakowitość i w efekcie pobranie kiszonek przez przeżuwacze.
Główną konsekwencją zmian we frakcjach azotowych podczas kiszenia (powstawanie związków charakterze niebiałkowym o niskiej masie cząsteczkowej) jest wzrost udziału puli azotu rozpuszczalnego w wodzie, co ma negatywny wpływ na jego wykorzystanie przez mikroorganizmy żwacza.
Charakterystyczne wartości azotu rozpuszczalnego w wodzie w kiszonkach z traw wynoszą 600-800 g/kg azotu ogólnego, w porównaniu do 200-250 g/kg azotu ogólnego w zielonkach. Nie ma jednoznacznych wyników dotyczących wpływu metody zbioru na zakres proteolizy. W badaniach Slottner i Bertilson (2006) stwierdzili, że zbiór zielonek nierozdrobnionych prasami zwijającymi powodował na ogół zmniejszenie rozkładu białka w porównaniu do zakiszania zielonek rozdrobnionych w silosie.
Metody ochrony białka kiszonki przed proteolizą
Podstawową metodą ograniczenia rozkładu białka w kiszonkach jest przyspieszenie zakwaszenia przez dodatek kwasów, m. in. kwasu mrówkowego. Większość badaczy stwierdza niższą rozkładalność żwaczową białka kiszonek z dodatkiem kwasu mrówkowego. Kiszonki bez dodatku charakteryzowały się współczynnikiem rozkładalności 0,82 podczas gdy kiszonki z dodatkiem kwasu mrówkowego wykazywały współczynnik 0,63. Dodatek ten ma więc korzystny wpływ na metabolizm azotu kiszonki u przeżuwaczy w porównaniu do kiszonki bez dodatku. Obniżenie pH poprzez wzrost poziomu kwasu mlekowego, uzyskać można przez stosowanie inokulantów bakterii homofermentacyjnych. Związki taninowe występujące w roślinach lub dodawane do zakiszanej masy wchodzą w trwałe kompleksy z białkami ograniczając ich degradację w czasie zakiszania oraz w żwaczu, zapobiegając jednocześnie wzdęciom. Część kompleksów białkowo taninowych jest jednak na tyle trwała, że zmniejsza znacznie strawność jelitową i dostępność chronionego białka dla przeżuwaczy.
Obecnie zwrócono uwagę na naturalnie występujący w roślinach czynnik ograniczający rozkład białka jakim jest enzym, oksydaza polifenolowa (PPO). Przekształca ona fenole do chinonów, a te wiążą się z białkami tworząc stabilne kompleksy zmieniając ich podatność na proteolizę. Wysoka aktywność PPO jest charakterystyczna dla koniczyn szczególnie koniczyny czerwonej. Rozkładalność związków azotowych w koniczynie czerwonej wynosi 65 proc., koniczynie białej 67 proc., trawach 70 proc. a w lucernie 72 proc., co częściowo tłumaczyć można właśnie obecnością PPO.
Wyprodukowanie kiszonki wysokiej jakości wymaga staranności na każdym etapie produkcji. Niewłaściwe warunki przy którymkolwiek z nich, obniżają jakość tej paszy, a w konsekwencji powodują utratę azotu, podwyższając koszty żywienia, zwiększając emisję azotu do środowiska a także przyczyniając się do zachwiania homeostazy w organizmie przeżuwaczy. Racjonalne gospodarowanie białkiem (azotem) ma ogromne znaczenie w kontekście produkcyjności bydła, dobrostanu, kosztów produkcji, a także jego emisji do środowiska.
dr hab. Purwin Cezary, Uniwersytet Warmińsko-Mazurski w Olsztynie, Katedra Żywienia Zwierząt i Paszoznawstwa
dr inż. Fijałkowska Maja, Uniwersytet Warmińsko-Mazurski w Olsztynie, Katedra Żywienia Zwierząt i Paszoznawstwa
rolniczeabc@rolniczeabc.pl
Artykuł ukazał się w miesięczniku "Rolnicze ABC" nr 4 (331) kwiecień 2018



Komentarze (0) pokaż wszystkie komentarze w serwisie
Dodaj komentarz Odśwież
Dodawaj komentarze jako zarejestrowany użytkownik - zaloguj się lub wejdź przez